Activités de l’EDQM relatives aux produits frontières
Comme leur nom l’indique, les produits frontières sont des produits qu’il est difficile de classer parmi les différentes catégories. Ces produits sont déjà sur le marché ou sortent de la chaîne de fabrication, mais le cadre législatif qui les régit n’est pas clair. Il est donc compliqué de déterminer l’Autorité nationale compétente censée agir comme cheffe de file sur le plan réglementaire et assumer la responsabilité de leur sécurité d’utilisation et des mesures d’exécution associées (retrait du marché des produits jugés dangereux et/ou non conformes). Or, il est crucial d’attribuer ces produits au bon domaine de compétence, car les exigences applicables, ainsi que les mesures de supervision et d’exécution varient grandement d’une catégorie de produits à l’autre.
Les compléments alimentaires sont un exemple type de produits frontières. On les classe, de manière générale, parmi les aliments. Pourtant, nombre d’entre eux sont à visée thérapeutique, et pourraient donc relever du cadre réglementaire régissant les médicaments.
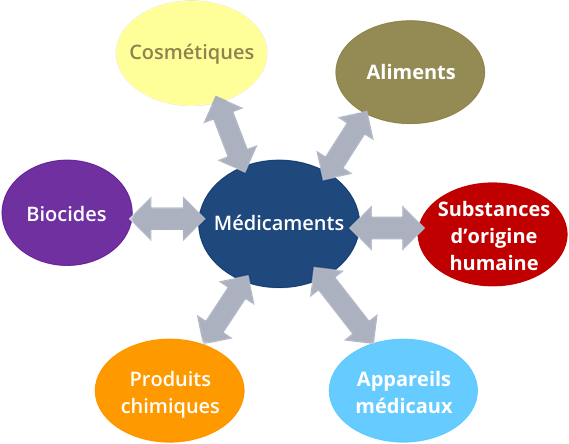
Fin 2018, le Comité d’Experts sur les normes de qualité et de sécurité relatives aux pratiques et au suivi pharmaceutiques (CD-P-PH/PC) et le Comité d’Experts sur la réduction des risques de santé publique liés à la falsification de produits médicaux et aux infractions similaires (CD-P-PH/CMED ont demandé la mise en place d’un groupe de travail conjoint pour se pencher sur les problèmes liés aux produits frontières. Un premier atelier a ainsi été organisé en octobre 2019. Rassemblant 43 spécialistes du sujet provenant de 25 États membres, il a abouti à la création du réseau de l’EDQM consacré aux produits frontières. En parallèle, le groupe de travail a commencé à élaborer un document d’orientation sur comment appliquer la législation relative aux médicaments aux produits frontières.
Ce réseau a officiellement été établi en décembre 2021 sous l’égide du CD-P-PH.
Mandat actuel (en anglais uniquement)
Objectifs
- Rassembler des informations pertinentes, exhaustives et actualisées grâce un réseau étendu de contacts internationaux.
- Mener des échanges informels sur les bonnes pratiques, sur le partage d’informations, sur les dernières évolutions et sur les expériences réussies, et aider à trouver d’autres solutions aux problèmes rencontrés à l’échelle nationale – et voir éventuellement les prémices d’une harmonisation des procédures
- Échanger des informations sur les nouveaux produits et leur impact
- Combler les écarts de compétences
- Couvrir l’ensemble des États membres du Conseil de l’Europe (et donc aller au-delà de l’Union européenne)
Périmètre d’action
- Les activités du réseau portent sur les produits qui se situent à la frontière entre les médicaments et les autres catégories de produits. Les problématiques liées à toute autre frontière sont hors périmètre.
- Le réseau se concentre sur les problèmes posés par les produits frontières lorsqu’il s’agit d’exécuter ou de superviser la législation relative aux médicaments.
- Les avis ou recommandations formulés au sein du réseau ne sont juridiquement contraignants pour aucun membre.
Programme de travail
- Axe principal : favoriser l’échange d’informations et les bonnes pratiques
- Fournir une plateforme d’échanges pour discuter de produits frontières, procédures ou problèmes spécifiques
- Soutenir la coopération entre les pays et épauler le CD-P-PH et ses sous-comités dans des tâches précises relatives aux produits frontières
- Garder une trace de l’historique des demandes d’information et des échanges qui en découlent
Membres
Les membres du réseau proviennent principalement des autorités réglementaires de santé des États membres du Conseil de l’Europe et disposent d’une expérience dans le domaine des médicaments ou des dispositifs médicaux. Parmi les membres, plusieurs font également partie d’autres groupes, comme le groupe chargé de la classification des produits frontières relevant du réseau Innovation de l’UE (EU-IN) et créé par l’Agence européenne des médicaments (EMA) et les Responsables d’agences du médicament (HMA), le comité des médicaments à base de plantes (HMPC) de l’EMA, ou encore le groupe nordique consacré aux produits frontières. On y retrouve également des membres de groupes travaillant sur l’aspect vétérinaire, comme le groupe de travail Produits frontières (BWG) du groupe de coordination de l’UE pour la reconnaissance mutuelle et les procédures décentralisées d’autorisation des produits à usage vétérinaire (CMDv). Cela permet de rationaliser les efforts et de suivre de près les nouvelles évolutions dans les autres groupes.
Le réseau se réunit au moins une fois par an en présentiel, et une fois par an à distance. Les réunions en présentiel sont organisées par les autorités des États membres.
Prochaine réunion
Mars 2025, Pologne
Réunions passées
2024, Sofia (Bulgarie) – sujets abordés :
- Échange d’informations général
- Impression 3D des médicaments
- "Le médicament : un concept juridique"
- Sessions en petits groupes sur l’exécution des mesures relatives aux produits frontières (en appui au groupe de travail conjoint)
- Questions relatives au réseau
2023, Berne (Suisse) – sujets abordés :
- Échange d’informations ciblé sur :
- l’exécution des mesures relatives aux produits hospitaliers
- la vente transfrontalière de produits frontières sur des plateformes
- les recherches en chimie
- Produits à base de plantes
- Coopération avec les laboratoires officiels de contrôle des médicaments (OMCL)
- Sessions en petits groupes sur ce que l’avenir nous réserve en matière de médicaments innovants
2022, locaux de l’EDQM – sujets abordés :
- Interactions avec les services de douanes
- Présentations brèves sur des cas précis (produits amaigrissants, « cosméceutiques », etc.)
- Sessions en petits groupes sur l’évaluation des risques liés aux produits frontières
- Session spéciale sur les produits à base de cannabis, avec l’intervention de l’Autorité européenne de sécurité des aliments (EFSA), et débat sur les difficultés majeures rencontrées par les autorités
Groupe de travail conjoint du CD-P-PH/PC et du CD-P-PH/CMED sur l’exécution des mesures relatives aux produits frontières
“Législation relative aux médicaments : comment l’appliquer aux produits frontières ? ”
Ce document d’orientation a pour but de donner aux États membres des méthodes pour tenir compte des produits frontières dans leurs travaux de supervision et d’exécution de la législation relative aux médicaments. Il propose des outils et des expériences, ainsi que des solutions aux problèmes liés aux produits frontières, mais les Autorités nationales compétentes demeurent responsables du choix de leurs méthodes. L’idée de ce document est de dresser une liste des outils utilisés par chaque pays et des méthodes appliquées, de mettre en avant les pratiques semblant particulièrement efficaces pour retirer du marché des produits non autorisés et de partager des exemples.
- Il servira de soutien aux Autorités nationales compétentes. Il ne s’agit pas de définir des procédures à appliquer par le réseau ou les autorités, mais de présenter les procédures appliquées actuellement et, le cas échéant, de mettre l’accent sur ce qui fonctionne et ce qui ne fonctionne pas, établissant ainsi un recueil de bonnes pratiques.
Voir aussi :



